Aprueban el primer tratamiento genético CRISPR: ¿cómo funciona y para qué enfermedades será utilizado?
El uso de técnicas de edición genética sobre seres humanos exige unas garantías de seguridad muy elevadas
Los CRISPR funcionan a modo de memoria inmunológica, ya que guardan la huella molecular de los virus en el ADN de las bacterias

Fact checked
Este artículo de OkSalud ha sido verificado para garantizar la mayor precisión y veracidad posible: se incluyen, en su mayoría, estudios médicos, enlaces a medios acreditados en la temática y se menciona a instituciones académicas de investigación. Todo el contenido de OkSalud está revisado pero, si consideras que es dudoso, inexacto u obsoleto, puedes contactarnos para poder realizar las posibles modificaciones pertinentes.
La Administración de Alimentos y Medicamentos de EEUU (FDA, por sus siglas en inglés) ha aprobado un tratamiento médico pionero que utiliza la edición genética CRISPR para el abordaje de pacientes con anemia de células falciformes, un trastorno sanguíneo hereditario. En Reino unido también están utilizando estos tratamientos y se espera que la Agencia Europea del Medicamento de luz verde a estas nuevas terapias para su uso en Europa.
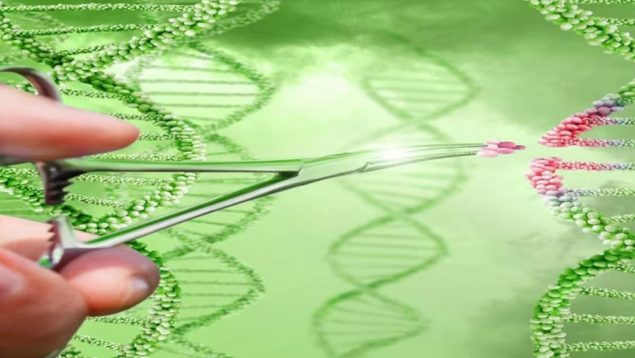
Pero, ¿qué es y cómo funciona esta nueva terapia? CRISPR es un acrónimo para Clustered Regularly Interspaced Short Palindromic Repeats, o Repeticiones Palindrómicas Cortas Agrupadas y Regularmente Espaciadas. En pocas palabras, son familias de secuencias de ADN que se encuentran en ciertas bacterias. Estas secuencias contienen, a su vez, fragmentos de ADN de virus que ya infectaron anteriormente a esas bacterias.
Los CRISPR funcionan a modo de memoria inmunológica, ya que guardan la huella molecular de los virus en el ADN de las bacterias. De esta forma, se pueden detectar y neutralizar nuevas infecciones, resultando inmunizadas dichas células.
El funcionamiento de CRISPR es sencillo de entender. Una enzima llamada Cas9 actúa como si fueran «tijeras moleculares». Su utilidad es cortar y modificar secciones de ADN asociados a una enfermedad (o, lo que es lo mismo, al ataque de un virus), o a cualquier tipo de defecto que precise ser reparado.
Así, en cuanto a la enfermedad producida por la anemia de células falciformes, el tratamiento elimina los episodios de dolor debilitante que caracteriza esta patología. Los científicos han conseguido editar las células de los pacientes fuera del cuerpo y anular el defecto genético que causa la enfermedad. El tratamiento podrá ser utilizado tanto por adultos como niños a partir de 12 años con ataques frecuentes de dolor. La terapia está diseñada para administrarse una sola vez, con beneficios potencialmente duraderos durante años o incluso décadas.
Las posibles aplicaciones de la tecnología CRISPR son ilimitadas. En placas de Petri y en animales modelo, los investigadores han usado el CRISPR para componer grandes errores genéticos, como los causantes de la distrofia muscular, de la fibrosis química y del síndrome del cromosoma X frágil. Asimismo, han aprovechado la tecnología para manipular cerdos a fin de obtener órganos para personas que necesitan trasplantes. Están en curso otros trabajos para eliminar las infecciones por VIH, crear antagonistas de microbios más inteligentes y controlar a los mosquitos portadores de enfermedades.
Nacimiento de la nueva edición genética
La colaboración entre la profesora Charpentier y la profesora Doudna ha permitido poner en común sus respectivos conocimientos especializados sobre bacterias patógenas y ARN de interferencia. Comenzaron en 2011 y, si bien fue, según la profesora Charpentier, “breve e intensa”, tendrá repercusiones durante muchos años. El principal logro de ambas investigadoras fue descubrir que las CRISPR (repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas), que constituyen un mecanismo de defensa natural del ADN de las bacterias, y la enzima Cas9 pueden ser programadas para cortar una molécula de ADN en cualquier punto.
Los primeros pasos
1953: Francis Crick y James Watson identifican la estructura molecular del ADN.
1987: Yoshizumi Ishino identifica estructuras repetidas en el ADN procariótico.
1993: Francisco Juan Martínez Mojica acuña el término CRISPR.
2005: Mojica propone que las CRISPR constituyen un mecanismo de defensa contra ADN foráneo.
2008: Erik Sontheimer y Luciano Marrafinni identifican el mecanismo CRISPR como una herramienta de edición de genes.
Primavera de 2011: La microbióloga Emmanuelle Charpentier y la bioquímica Jennifer Doudna se reúnen durante una conferencia en Puerto Rico y debaten por primera vez sobre el sistema CRISPR-Cas9.
Bioética de CRISPR
La técnica CRISPR de edición genética plantea diversos retos relacionados con la bioética. Aunque las principales aplicaciones son positivas, al poner una tecnología tan asequible en cuestión de costes al alcance de todo el mundo, se pueden traspasar ciertas barreras.
En el caso de los usos de la edición genética en la industria primaria, agricultura y ganadería, siempre que impliquen un beneficio para la humanidad, son positivos. Eso sí, es necesario analizar cada caso por separado. Por ejemplo, la manipulación de las especies vegetales para que sean resistentes a las plagas representa un gran beneficio para la humanidad.
Por otro lado, si atendemos a la intervención sobre los ecosistemas hay que tener más precaución, ya que cualquier alteración inesperada puede conllevar problemas graves o incontrolables.
En cuanto a las aplicaciones médicas, el uso de técnicas de edición genética sobre seres humanos exige unas garantías de seguridad muy elevadas, y deberían utilizarse tan sólo para las patologías donde actualmente no existen tratamientos efectivos, o en patologías en las que los tratamientos actuales impliquen efectos secundarios de importancia.









